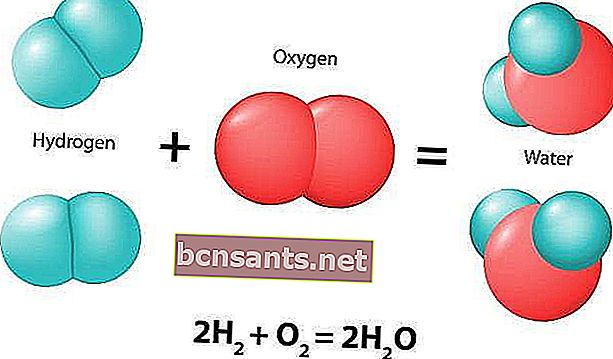
Reaksi kimia adalah proses semula jadi yang selalu menghasilkan perubahan sebatian kimia. Sebatian awal atau sebatian yang terlibat dalam tindak balas dipanggil reaktan.
Reaksi kimia biasanya dicirikan oleh perubahan kimia, dan akan menghasilkan satu atau lebih produk yang biasanya mempunyai ciri yang berbeza dari reaktan. Berikut adalah contoh tindak balas kimia:
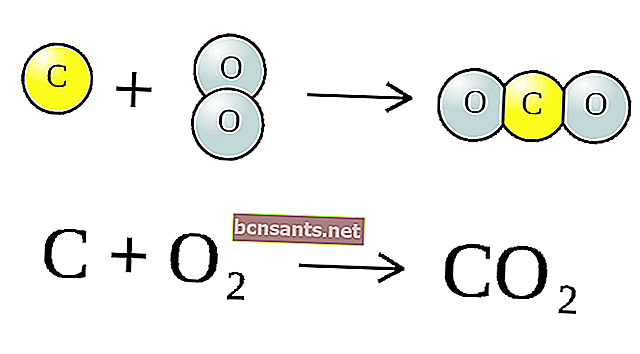
Tindak balas kimia di atas adalah molekul (CO2) yang terdiri daripada satu atom karbon (C) dan dua atom oksigen (O) ditambah satu karbon (C), menghasilkan 2 atom karbon monoksida (CO).
Gabungan simbol ini dipanggil Persamaan Kimia . Bahan di sebelah kiri anak panah disebut per-reaksi (CO2) dan C, dan setelah anak panah disebut produk reaksi, yaitu CO.
Ciri-ciri Tindak balas Kimia
Reaksi kimia di dunia nyata sangat mudah dicari, misalnya ketika membakar kertas. Kertas awal masih dalam bentuk kepingan putih, setelah membakarnya menggunakan api, kertas berwarna dibakar.

Selain itu, ketika kita mendidih air. Air cair seterusnya menjadi gas dan wap air setelah direbus dalam periuk yang diletakkan di atas dapur.
Kejadian ini adalah tanda tindak balas kimia yang nyata. Walau bagaimanapun, untuk pembentukan produk hasilnya sangat sukar dilihat. Berikut adalah ciri tindak balas kimia:
1 . Perubahan warna
Molekul / sebatian kimia mempunyai kemampuan untuk menyerap warna dan mengeluarkan warna bergantung pada zatnya. Keupayaan ini juga dapat dipengaruhi oleh suatu peristiwa.
Contohnya: Reaktan besi yang dibiarkan di tempat terbuka terlalu lama dan dalam keadaan basah akan berkarat (kuning kecoklatan).
2. Perubahan Suhu
Molekul / sebatian kimia mempunyai tenaga dalaman dalam bentuk ikatan kimia. Ikatan ini memerlukan tenaga atau dapat membebaskan tenaga.
Apabila banyak ikatan terbentuk, tenaga dibebaskan apabila suhu meningkat Contohnya: Membakar gas LPG di atas dapur
3. Kemunculan gelembung gas
Gas dalam tindak balas kimia boleh berlaku kerana pemanasan.
Contohnya: Molekul / sebatian baking soda dalam adunan apabila dipanaskan akan mengeluarkan gas sehingga kek mengembang.
4. Perubahan Isipadu
Apabila produk yang dihasilkan daripada tindak balas kimia terbentuk, ini bermakna jumlah reaktan dikurangkan. Contohnya: Isipadu air tasik menurun pada musim panas.
5. Sedimen Terbentuk
Endapan adalah tindak balas kimia sisa antara dua larutan yang menjadi padat. Bahan ini boleh berlaku kerana larutan terlalu tepu.
Contohnya: Larutan perak nitrat (AgNO3) ditambahkan ke larutan yang mengandungi kalium klorida (KCl), satu endapan putih klorida perak (AgCl) akan terbentuk.
6. Pemancaran Cahaya
Reaksi kimia kadangkala membebaskan tenaga dalam bentuk cahaya
Contohnya: Tindak balas terhadap matahari
7. Perubahan Kekonduksian
Reaksi kimia mempengaruhi perubahan kekonduksian (keupayaan untuk melakukan haba).
8. Perubahan rasa
Tindak balas kimia ketika mengunyah nasi menimbulkan rasa manis ketika menyentuh lidah.
Faktor yang mempengaruhi

Kadar tindak balas atau kelajuan dalam tindak balas kimia menyatakan bilangan tindak balas kimia yang berlaku setiap unit masa.
Kadar ini dipengaruhi oleh beberapa faktor yang dapat mempercepat atau melambatkan proses reaksi. Inilah faktornya.
1. Pengukuran Reaktan
Garam kasar atau garam yang masih ada ketulan. Garam kasar ini larut dengan perlahan di dalam air kerana saiznya yang besar. Sehingga tindak balas kimia sangat bergantung pada ukuran bahan.
Baca juga: Permintaan dan Penawaran - Definisi, Undang-undang dan Contoh2. Suhu
Suhu boleh mempengaruhi tindak balas kimia, iaitu dengan pemanasan. Contohnya, pada musim panas, hutan kayu terbakar lebih cepat daripada pada musim hujan.
3. Pemangkin
Pemangkin adalah bahan yang mempercepat kadar tindak balas kimia pada suhu tertentu, tanpa mengalami perubahan atau habis oleh reaksi itu sendiri. Enzim adalah salah satu jenis pemangkin. Tanpa enzim, reaksi ini akan menjadi terlalu lambat untuk metabolisme berlaku.
Sebagai contoh, Maltase Enzyme menukar maltosa (sejenis polisakarida atau gula kompleks) menjadi glukosa. Berikut adalah skema tindak balas katalitik umum, di mana C mewakili pemangkin:
A + C → AC (1)
B + AC → AB + C (2)
Tahap Reaksi Kimia
Tahap reaksi mudah dibahagikan kepada:
- Penamatan hubungan,
- Pembentukan sebatian peralihan
- Pembentukan Bon
Untuk sebatian bimolekul, langkahnya lebih kompleks kerana tindak balas unsur.
- Tahap permulaan tindak balas
- Penamatan hubungan
- Pembentukan sebatian peralihan
- Pembentukan produk
- Penstabilan tenaga (dengan menyerap atau melepaskan tenaga / biasanya panas)
Pelbagai
Reaksi kimia sangat pelbagai, tetapi dapat diklasifikasikan menjadi beberapa jenis reaksi, iaitu:
1. Tindak Balas Penggabungan
Tindak balas dua bahan yang bergabung membentuk zat baru. Contoh yang mudah ialah pembentukan garam NaCl: 2Na + Cl2 → 2NaCl
2. Penguraian Reaksi
Sebatian yang berlaku dalam tindak balas kimia dipecah menjadi lebih daripada dua bahan. Contohnya ialah penguraian air H2O: 2H2O → 2H2 + O2
3. Reaksi Pertukaran Tunggal
Reaksi pertukaran adalah reaksi di mana unsur bertindak balas dengan sebatian untuk menggantikan unsur-unsur yang terdapat dalam sebatian itu. Sebagai contoh, jika tembaga dicelupkan dalam larutan nitrat perak, kristal logam perak dihasilkan. Persamaan untuk tindak balas adalah:
Cu + 2AgNO 3 (aq) → 2Ag (s) + Cu (NO 3 ) 2 (aq)
4. Reaksi pertukaran berganda
Biasanya disebut reaksi metathesis, ia adalah reaksi pertukaran bahagian dari reaktan. Sekiranya reagen adalah sebatian ion laurtan, bahagian yang ditukar adalah kation dan anion sebatian. Contohnya, tindak balas asid dengan basa seperti:
HCl (aq) + NaOH (aq) → NaCl (aq) + H 2 O (l)
5. Tindak Balas Pembakaran
Tindak balas ini dapat dikenali sebagai reaksi untuk menyusun semula atom. Tanda yang salah satu reagen adalah oksigen.
Maksudnya, reaksi pembakaran adalah tindak balas kimia suatu bahan dengan oksigen, biasanya bertindak balas lebih cepat dengan pembebasan haba sehingga api muncul. Contohnya membakar metana
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
Contoh Reaksi Kimia
Terdapat banyak reaksi yang dapat dijumpai dalam kehidupan sebenar. Sebahagiannya disengajakan dalam bentuk praktikum di makmal sehingga berlaku secara semula jadi.
Sebilangan reaksi kimia ini mungkin termasuk reaksi penggabungan ke dalam produk baru, pembakaran, penguraian dan lain-lain. Berikut adalah beberapa reaksi biasa:
1. Pembentukan Sabun

Tindak balas anak pokok adalah tindak balas hidrolisis lemak / minyak menggunakan asas kuat seperti NaOH atau KOH untuk menghasilkan garam atau sabun gliserol dan asid lemak. NaOH digunakan untuk menghasilkan sabun keras, sementara KOH digunakan untuk menghasilkan sabun lembut atau sabun cair.
Perbezaan antara sabun keras dan lembut apabila dilihat dari kelarutannya dalam air adalah bahawa sabun keras kurang larut dalam air jika dibandingkan dengan sabun lembut. Reaksi saponifikasi juga disebut reaksi saponifikasi.

2. Tindak balas Asid-Asas Terhadap Garam
Baca juga: 4 Prinsip Geografi dan Penerapannya dalam Kehidupan KitaDalam kimia, garam adalah sebatian ion yang terdiri daripada ion positif (kation) dan ion negatif (anion), membentuk sebatian neutral (tanpa dikenakan). Garam terbentuk dari tindak balas asid dan basa. Garam juga boleh terbentuk dari dua garam yang berbeza seperti:
Pb (NO 3 ) 2 (aq) + Na 2 SO 4 (aq) → PbSO 4 (+) + 2 NaNO 3 (aq)
3. Tindak balas kakisan
Kakisan adalah kerosakan pada logam akibat tindak balas redoks antara logam dan pelbagai bahan di persekitarannya yang menghasilkan sebatian yang tidak diingini.
Dalam proses pengaratan, besi (Fe) bertindak sebagai agen pengurang dan oksigen (O2) yang dilarutkan dalam air bertindak sebagai pengoksidasi. Persamaan tindak balas untuk pembentukan karat adalah seperti berikut:
Fe ( s ) → Fe2 + ( aq ) + 2e–
O 2 ( g ) + 4H + ( aq) + 4e– → 2H 2 O ( l )
4. Tindak balas fotosintetik
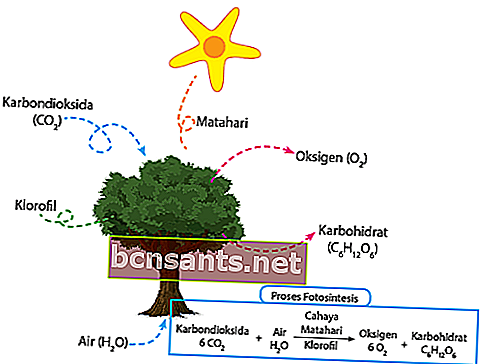
Menurut KBBI, proses fotosintesis adalah tumbuhan hijau yang menggunakan cahaya matahari untuk menukar air dan karbon dioksida menjadi karbohidrat. Karbon dioksida yang terdapat di sekitar tumbuhan diserap secara langsung melalui tisu stomata di dalam daun. Air yang terdapat di sekitar tanaman, diserap secara langsung melalui akar dan disalurkan ke daun melalui batang tanaman.
Tepat pada tengah hari, intensiti cahaya yang turun secara langsung ditangkap oleh klorofil untuk fotosintesis. Tenaga dari cahaya matahari yang telah ditangkap sebelumnya akan secara langsung mengubah air menjadi oksigen dan hidrogen.
Akhirnya, hidrogen yang telah dihasilkan akan digabungkan secara langsung dengan karbon dioksida untuk menghasilkan makanan untuk keperluan tanaman ini. Selebihnya, oksigen akan dilepaskan terus ke udara melalui stomata. Berikut adalah persamaan kimia:
6CO2 + 6H2O + cahaya = C6H12O6 + 6O2
5. Reaksi Kimia Cuka dan Baking Soda
Adakah anda pernah diajar mengenai reaksi kimia jika cuka dan baking soda boleh menyebabkan letusan gunung berapi di sekolah anda?
Sebatian berasid yang dicampurkan dengan sebatian alkali akan menghasilkan sebatian neutral. Dalam eksperimen, sebatian asid lemah dicampurkan dalam larutan asid asetik (CH3COOH) dengan sebatian asas kuat dalam larutan baking soda (NaHCO3).

Dalam tindak balas kimia, satu atau lebih zat dapat ditukar menjadi bahan baru, menurut eksperimen, cuka asam (CH3COOH) ditindak balas dengan baking soda (NaHCO3) untuk menghasilkan gas CO2.
Sekiranya cuka asid (CH3COOH) dan baking soda (NaHCO3) ditindak balas, ia akan menghasilkan gelembung yang menyebabkan pembentukan gas karbon dioksida (CO2). Gas dan cecair ini akan menyebabkan cecair seperti lava keluar.
6. Tindak balas kimia enzimatik
Enzim adalah biomolekul dalam bentuk protein yang berfungsi sebagai pemangkin (sebatian yang mempercepat proses tindak balas tanpa bertindak balas sepenuhnya) dalam tindak balas kimia organik.
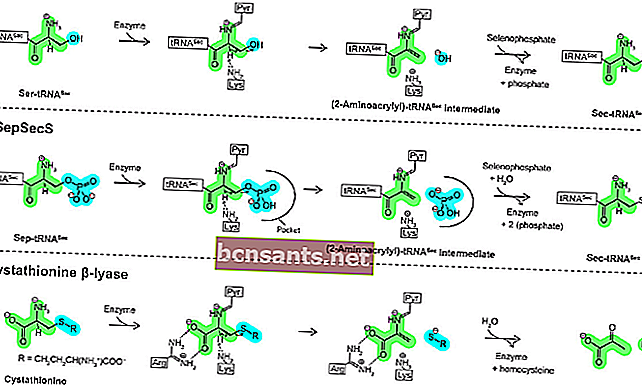
Walaupun sebatian pemangkin dapat berubah pada reaksi awal, pada reaksi akhir molekul pemangkin akan kembali ke bentuk asalnya. Enzim berfungsi dengan bertindak balas dengan molekul substrat untuk menghasilkan sebatian perantaraan melalui tindak balas organik yang memerlukan tenaga pengaktifan yang lebih rendah, sehingga tindak balas kimia mempercepat kerana reaksi kimia dengan tenaga pengaktifan yang lebih tinggi mengambil masa lebih lama.
Contohnya: Enzim katalase adalah enzim yang memangkinkan tindak balas di mana hidrogen peroksida dipecah menjadi air dan oksigen.
